Когда мне вплотную пришлось заняться гальванопластикой, я пересмотрел массу литературы на эту тему в печатных изданиях и в Интернете. Получилось так, что указанная выше статья оказала мне наибольшую практическую помощь, что и послужило толчком для подготовки этого материала для сайта <Верфь на столе>.
Из
цветных металлов, нашедших применение в технике гальванопластики,
наибольшее распространение получила медь и ее сплавы. При работе с
этими металлами возможно получение хороших результатов даже в домашних
условиях. Они очень легко осаждаются на различные металлы и их сплавы.
Правда, в зависимости от материала основы, имеются определенные
тонкости осуществления процесса.
Для получения качественных покрытий
большое значение имеет правильная завеска детали в ванну и расположение
анодов. Пример правильного расположения заготовки для осаждения слоя
железа на наружную поверхность приведен на рис.1.
На рис.1а - вид сверху, на рис.1б - разрез рабочей ванны, где цифрами обозначены: 1 -диэлектрический химически стойкий сосуд; 2 -аноды; 3 - заготовка, 4 - поверхность электролита.
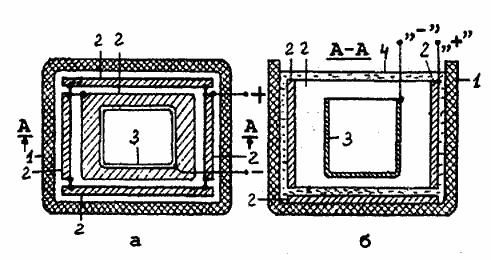
Рис.1
На рис.2а показано рекомендуемое взаимное расположение обрабатываемой детали 3 и анода 2 в ванне при нанесении покрытия на внутреннюю поверхность заготовки. В ходе рабочего процесса электролит, находящийся в застойных зонах (обозначены цифрой 5) , быстро истощается, что приводит к получению неравномерных осадков низкого качества. Кроме того, при электролизе как на аноде, так и на катоде выделяются газы. Их пузырьки могут вообще преградить доступ раствора к электродам, а это тоже приводит к браку. Поэтому требуется интенсивное перемешивание электролита. Рекомендуемое направление его потока показано сплошными стрелками. Этим же потоком с анода смывается шлам. Последний оседает на дне ванны и не мешает нормальному протеканию рабочего процесса, что повышает качество получаемого покрытия.
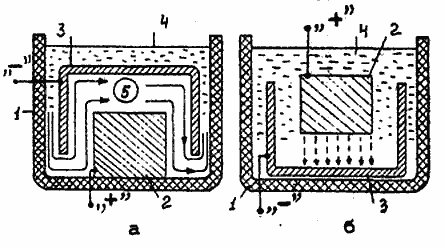
Рис.2
На разрезе рис. 2а цифрами 1 и 4 обозначаются диэлектрический кислотостойкий сосуд и поверхность электролита соответственно. На рис. 2б показана неправильная загрузка детали 3. В этом случае шлам, срываясь с анода 2, ложится на поверхность обрабатываемой детали. Траектория его движения обозначена в виде штриховой линии со стрелками. Ввиду большого удельного веса, частицы шлама не вымываются из обрабатываемой зоны даже сильным потоком электролита. Эти примеси, соприкасаясь с отлагающимся на катоде металлом, включаются в его кристаллическую структуру и приводят к образованию шишек и шероховатостей. Последние мешают дальнейшему равномерному отложению осадка. Точно так же, как и на предыдущих разрезах, цифрой 1 обозначается диэлектрический химически стойкий сосуд, а 4 - поверхность электролита.
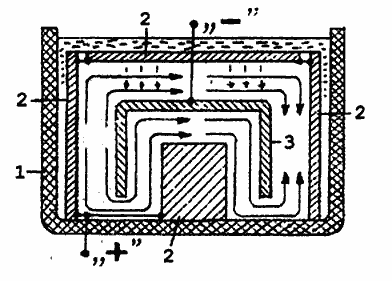
Рис.3
При
необходимости одновременного нанесения покрытия на обе поверхности
детали 3 можно воспользоваться схемой, приведенной на рис.3. В этом
случае также обязательно требуется интенсивное перемешивание рабочего
раствора. Это необходимо как для разрушения застойных зон, так и для
смыва с поверхности детали 3 шлама, выпадающего с горизонтального анода
2. Траектория перемещения частиц шлама условно показана штриховыми
линиями со стрелками, а рекомендуемое направление движения потока
электролита - сплошными линиями со стрелками. Если же не удается
обеспечить показанное взаимное расположение детали и анодов и/или
достаточно интенсивного перемешивания рабочего раствора, следует
воспользоваться раздельной обработкой поверхностей заготовки, которая
осуществляется так:
До операции декапирования детали обрабатывают
обычным способом с двух сторон. Далее на одну из поверхностей, которая
пока не будет подвергаться обработке, наносится кислотоупорное
покрытие. Это могут быть очень простые по составу и приготовлению, но к
сожалению не термостойкие слои на основе воскообразных веществ, таких
как парафин, стеарин, воск, озокерит, церезин, растворимых в скипидаре.
Соотношение твердого вещества и растворителя обычно составляет 2:9,
взятых по массе. Приготовляют этот состав следующим образом. На водяной
бане, и только на ней, расплавляют воск, а потом вводят в него теплый
скипидар. Чтобы защитный состав был более контрастным по цвету, а это
позволяет более четко контролировать его наличие, толщину слоя и его
качество, в расплав можно добавить небольшое количество любой
спирторастворимой краски. Если же таковой не имеется, то несложно
ввести в смесь немного сапожного крема.
Довольно часто применяется и
более сложная по составу защитная смесь, изначально уже имеющая темный
цвет. В ее рецепте, который приводится ниже, количество веществ указано
в процентах по массе: парафин - 70, пчелиный воск - 10, канифоль - 10,
пековый лак - 10. Все компоненты этого состава предварительно
смешивают, после чего их осторожно расплавляют на малом огне и
тщательно перемешивают расплав. Воскообразные защитные покрытия наносят
на поверхность детали в горячем виде кистью или тампоном. Все они
рассчитаны на рабочую температуру не выше 60°С. Несколько лучшей
термостойкостью (рабочая температура до 85°С) обладают защитные слои,
выполненные на основе асфальтовых, битумных и пековых лаков. Обычно их
разжижают скипидаром в соотношении 1:1 по массе. Холодная смесь
наносится на поверхность заготовки кистью либо тампоном. Время ее
высыхания при комнатной температуре составляет примерно 12-16 часов.
Перхлорвиниловые эмали, лаки, краски позволяют поднять рабочую
температуру химических ванн до 95°С, а масляно-битумные лаки и эмали,
асфальто-масляные и бакелитовые лаки выдерживают нагрев до 120°С.
Наиболее кислотоупорным и теплостойким защитным составом является смесь
клея 88Н или <Момент> с наполнителем. В качестве последнего
допустимо применить фарфоровую муку, каолин, тальк, зеленую окись хрома
(III)- Cr2О3. Компоненты смеси следует взять в соотношении 1:1 по
массе. Необходимую вязкость защитного слоя получают добавлением к смеси
разбавителя, который состоит из двух объемных частей бензина и одной
части этилацетата либо бутилацетата. Рабочая температура такого
защитного покрытия до 150°С.
Подавляющее большинство электролитов
меднения готовят на основе кристаллогидратного сульфата меди, в обиходе
именуемого <медным купоросом>, квалификации не ниже <Ч>.
Использование технического медного купороса следует признать допустимым
только в самых крайних случаях. Такая соль содержит значительное
количество примесей, вследствие чего образуются осадки пониженного
качества.
Работа с электролитами меднения имеет свою специфику.
Начнем с основного правила непосредственного нанесения медных покрытий
на железо или его сплавы: во избежание контактного выделения меди на
поверхности заготовок их загружать в электролит можно только под током,
в противном случае прочное сцепление осадка с материалом основы не
обеспечивается. Очень важную роль в данной ситуации имеет и
первоначальная плотность тока. Это объясняется тем, что при чрезмерно
высокой силе тока образуются хотя и плотные, но грубокристаллические
осадки, которые в дальнейшем приведут, в лучшем случае, к получению
волнистых или бугорчатых покрытий непредсказуемой толщины. При слишком
малой плотности тока скорость образования гальванического покрытия
будет отставать от скорости выделения контактновыделенной меди, что в
последующем вызывает отслаивание покрытия. Для каждой разновидности
электролитов меднения существует своя, строго определенная оптимальная
плотность тока. Практически же оптимальная плотность тока подбирается
по внешнему виду получаемого покрытия и скорости его образования. При
наличии сравнительно небольшого навыка, который приобретается очень
быстро, подобный способ управления ходом процесса обеспечивает
получение покрытий очень высокого качества. При правильно подобранном
режиме гальванического процесса осажденный слой меди имеет телесный
цвет и равномерную мелкокристаллическую структуру. При чрезмерно
больших плотностях тока слой меди получается с грубыми зернами металла
и характерным кирпично-красным цветом. О последнем дефекте принято
говорить, что происходит <подгар> покрытия. Превышение силы тока,
помимо возникновения <подгара> может привести к пассивации
анодов. При этом на поверхности последних наблюдается белый,
зеленовато-голубой или коричневый мажущийся, легко стираемый налет,
который препятствует нормальному процессу растворения металла. При этом
на образование покрытия расходуются соли меди, содержащиеся в
электролите, что приводит к неустойчивости его химического состава.
Помимо завышенной плотности тока причиной пассивации анодов может быть
и неправильный выбор соотношения катодной и анодной площадей. Для
большинства электролитов меднения оптимальным является превышение
активной поверхности анода в 2,..2,5 раза против площади катода. Аноды
выполняются из чистой меди, а требования к их расположению относительно
заготовок аналогичны правилам, изложенным при описании процессов
железнения и никелирования.
Из всего разнообразия растворов меднения
наибольшее распространение получили т.н. кислые сульфатные электролиты.
Они отличаются малой токсичностью, дешевизной и распространенностью
используемых в них компонентов.
Таблица 1 меднение
Вещество , г/л |
№1 |
№2 |
№3 |
№4 |
№5 |
№6 |
|---|---|---|---|---|---|---|
Сульфат меди |
200-250 |
60-80 |
- |
200 |
300 |
250 |
Хлорид меди |
- |
- |
20-30 |
- |
- |
- |
Сульфат никеля |
- |
- |
- |
- |
1 |
- |
Ангидрид хрома |
- |
- |
- |
- |
- |
2 |
Тиомочевина |
- |
- |
- |
0,44 |
- |
- |
Желатин |
- |
ДО 1 |
- |
- |
- |
- |
Серная к-та, (пл.1,84),мл/л |
30-45 |
100-120 |
- |
28-32 |
40-45 |
12-15 |
Соляная к-та, (пл. 1,19), мл/л |
- |
7,7-8 |
310-450 |
- |
- |
- |
Уксусная к-та, (пл. 1,05), мл/л |
- |
- |
5-9 |
- |
- |
- |
Спирт этиловый (96%) |
до 6 |
- |
- |
- |
1-2 |
- |
Температура ,°С |
18-40 |
18-25 |
12-25 |
12-20 |
40-45 |
10-25 |
Пл. тока, А/ дм2 |
1-30 |
1-5 |
1-1,5 |
до 7 |
3-10 |
5 |
Рецептура такого электролита меднения помещена в табл.1 под №1. Он является электролитом меднения, получившим наиболее широкое распространение как в промышленности, так и в лабораторной практике. Отличается высокой стабильностью химического состава во время хранения и в процессе работы, большой гибкостью рабочих режимов. Изменением режимов электролиза и концентрации основных компонентов можно получать покрытия самого различного назначения. Присутствующий в данном растворе этиловый спирт не является обязательным компонентом. Его наличие значительно улучшает качество осаждаемой меди, делая структуру покрытия более плотной и значительно уменьшает зерно металла, что позволяет вести электролиз при повышенных плотностях тока. Плотность тока не должна превышать 2 А/дм2 при эксплуатации ванны при комнатной температуре без перемешивания и фильтрации. В ваннах, перемешиваемых сжатым воздухом, плотность тока можно поднять до 5 А/дм2, а при нагреве раствора до 40°С даже до 10 А/дм2. Благодаря введению в электролит этилового спирта либо фенола максимально допустимая плотность тока возрастает в 1,5...2 раза. Применив для раствора с такими добавками интенсивное перемешивание, непрерывную фильтрацию и подогрев жидкости до 40°С, можно довести катодную плотность тока до 30 А/дм2, ускорив тем самым процесс электролиза.
Кислые сульфатные электролиты способны выручить в том случае, когда отсутствует возможность приготовления специальных растворов, предназначенных для непосредственного меднения железа и его сплавов. И хотя работа с сульфатным электролитом при отсутствии подслоя весьма затруднена, что связано с контактным выпадением меди на поверхности заготовки, при введении в раствор специальных органических добавок, тормозящих процесс контактного обмена, появляется возможность получения из таких составов покрытий, достаточно прочно сцепленных с материалом основы. Наиболее доступными органическими соединениями, пригодными для этой цели, являются желатин и столярный клей. Примером электролита данной разновидности является рецепт №2. От стандартного сульфатного раствора он, помимо наличия органической добавки, отличается пониженной концентрацией солей меди и повышенным содержанием серной кислоты. При отсутствии желатина его можно заменить тем же количеством любого коллагенового столярного клея: костного, мездрового или рыбьего. Перед приготовлением рабочего раствора указанные компоненты распускают в теплой воде до получения сиропообразной массы и уже в таком виде вливают в электролит. Вводить указанные добавки следует очень осторожно, малыми порциями и в суммарной концентрации не более 0,8-1 г/л, не забывая выполнять пробную обработку заготовок после каждой корректировки состава электролита.
Начать обработку деталей в предложенном растворе необходимо с толчка тока. Практически это осуществляется следующим образом. Вначале на электродах ванны устанавливается напряжение 5...7 В, после чего заготовки опускают в электролит. Далее очень быстро в течение 1...2 с напряжение повышают таким образом, чтобы катодная плотность тока превышала максимально допустимую для данного состава величину в 3...5 раз. Через 30...60 с, необходимых для полного затягивания поверхности деталей медью, силу тока плавно в течение 1,5...2 минут уменьшают до нижней допустимой границы. По мере наращивания толщины осадка плотность тока можно увеличить. Весьма прост по составу хлоридно-ацетатный электролит №3, предназначенный для непосредственного меднения железа и его сплавов. Электролит №4 применяется при необходимости получения полублестящих покрытий при комнатной температуре. Так же эксплуатируется электролит №6. Благодаря наличию в нем небольшого количества хромового ангидрида, который эффективно растворяет крупные кристаллы и наросты меди, появляется возможность получения плотных равномерных покрытий большой толщины при повышенных плотностях тока. Приличной производительностью обладает ванна №5. Покрытия, осаждаемые в ней, содержат небольшое количество никеля. Ее повышенная рабочая температура позволяет увеличивать плотность тока, которая при перемешивании раствора сжатым воздухом может достигать 10 А/дм2.
Приготовление кислых сульфатных электролитов трудностей не представляет. Вначале необходимо растворить сульфат меди, причем делать это лучше всего в теплой или горячей воде. После охлаждения раствора до комнатной температуры жидкость фильтруют, а затем в нее осторожно вливают серную кислоту, тонкой струйкой и при непрерывном помешивании (иначе возможно быстрое разогревание жидкости и ее разбрызгивание, а это способно привести к тяжелым ожогам). Следует помнить, что растворимость медного купороса значительно снижается с увеличением концентрации кислоты. При повышенном содержании сульфата меди он выкристаллизовывается на стенках ванны и, что еще хуже, на аноде, затрудняя процесс электролиза. Вследствие этого получаемые осадки имеют крупнокристаллическую структуру. Для устранения данного явления следует уменьшить концентрацию солей меди в электролите, разбавив его водой. При недостаточном содержании серной кислоты получаются рыхлые, губчатые, легко стирающиеся осадки, совершенно непригодные для практических целей. Одновременно этим снижается рассеивающая способность ванны, а аноды покрываются тонким налетом. Этот налет имеет повышенное электрическое сопротивление, вследствие чего плотность тока снижается через насколько минут после начала процесса электролиза. В таком случае в электролит необходимо добавить чистой серной кислоты в количестве 10% от предписанного рецептурой.
Очень красивый внешний вид имеют покрытия из сплавов на основе меди. По сравнению с чисто медными осадками такие сплавы имеют более высокую механическую прочность и коррозионную стойкость. По причине пониженной производительности ванн наносить такие покрытия целесообразно только на предварительно осажденный слой меди достаточной толщины.
Таблица 2 сплавы
Вещество , г/л |
№1 |
№2 |
№3 |
№4 |
№5 |
№6 |
|---|---|---|---|---|---|---|
Сульфат меди |
40-55 |
25-35 |
20-30 |
- |
23-27 |
120-135 |
Фторид меди |
- |
- |
- |
9-10 |
- |
- |
Сульфат цинка |
35-55 |
- |
- |
- |
- |
|
Гидрофосфат цинка |
- |
35-45 |
- |
- |
- |
- |
Хлорид олова |
- |
- |
3-5 |
22-25 |
- |
- |
Сульфат никеля |
- |
- |
- |
- |
480 |
310-330 |
Гидроксид натрия |
80-100 |
- |
- |
- |
- |
- |
Ортофосфат натрия |
- |
180-200 |
- |
- |
- |
|
Калия-натрия тартат |
380-420 |
- |
- |
25-30 |
25-30 |
|
Пирофосфат калия |
. |
- |
- |
350 |
65-70 |
65-70 |
Гидрофосфат аммония |
- |
25-50 |
- |
- |
- |
- |
Трилон Б |
- |
20-60 |
- |
- |
- |
- |
Желатин |
- |
- |
- |
0,2-0,4 |
- |
- |
Ортофосф, к-та (пл.1,7), мл/л |
- |
60-120 |
- |
- |
- |
|
Температура,°С |
45-50 |
18-24 |
18-25 |
18-25 |
55-60 |
55-60 |
РН |
- |
1,1-2 |
- |
- |
9,2-9,6 |
9,2-9,6 |
Пл. тока, А/ дм2 |
1-1,5 |
1-25 |
0,5-1 |
1-2 |
0,5-1 |
1,5-20 |
Содерж. меди, % |
70 |
90-95 |
80-90 |
80-90 |
30-40 |
80 |
В табл.2 даны составы, позволяющие получить сплавы типа латуней - рецепты №1 и 2, медно-оловянные бронзы - рецепты №3, 4 и медно-никелевые сплавы типа монель-металл - рецепт №5 и типа мельхиор, рецепт №6. Цвет получаемых покрытий - от розового через различные оттенки желтого до белого с синим оттенком.
При работе с электролитом №1 аноды должны быть изготовлены из латуни Л68. Для состава №2 больше подходят раздельные аноды из меди и цинка, причем соотношение их площадей должно быть примерно 7...9 к 1. Кроме этого, необходимо предусмотреть раздельный подвод тока к каждой группе анодов с возможностью индивидуальной регулировки силы тока. При работе с электролитами бронзирования используются аноды из листовой желтой бронзы, например, Бр.ОФЮ-0,1, Бр.ОФ7-0,2 и т.п. Оптимальное соотношение площадей катода и анодов от 1:2 до 1:3,5 как при латунировании, так и при покрытии деталей бронзой. Для осаждения сплавов никель-медь потребуются аноды из сплава, содержащего 60...70% Ni 40...30 % Cu для электролита №5 и из мельхиора для рецепта №6. Возможно также применение раздельных анодов с соответствующим распределением их площадей. Для этих сплавов оптимальное соотношение катодной и анодной площади составит 1:1.
Завершающий этап обработки заготовок начинается с химического или электрохимического полирования. Их рецептура и режимы обработки сведены в табл.3.
Таблица 3 полирование
|
Вещество, мл/л |
№1 |
№2 |
№3 |
№4 |
№5 |
№6 |
№7 |
№8 |
№9 |
№10 |
№11 |
№12 |
№13 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Серная к-та, (пл.1,84) |
100 |
30 |
400 |
80 |
- |
- |
- |
- |
- |
150-300 |
- |
100 |
|
|
Соляная к-та, (пл.1,19) |
- |
т. |
5 |
1 |
10 |
- |
- |
. |
- |
- |
- |
- |
- |
|
Азотная к-та, (пл.1,4) |
- |
- |
100 |
20 |
20 |
- |
65 |
210-230 |
300 |
200 |
- |
- |
- |
|
Уксусная к-та, (пл.1,05) |
- |
- |
- |
- |
40 |
30 |
5 |
_ |
700 |
400 |
- |
- |
- |
|
Ортоф. к-та, (пл, 1,7) |
- |
- |
- |
40 |
- |
30 |
770-790 |
- |
400 |
300-650 |
- |
- ' |
|
|
Перекись водорода 30% |
50 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Стабилизир. добавка |
10-15 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Ангидрид хрома, г/л |
- |
350 |
300 |
50 |
- |
- |
- |
- |
- |
- |
30-80 |
100 |
- |
|
Хлорид натрия, г/л |
- |
50 |
- |
- |
- |
160 |
1 |
- |
- |
- |
- |
- |
- |
|
Сульфат меди, г/л |
- |
- |
- |
- |
80 |
- |
- |
- |
- |
' |
- |
- |
|
|
Температура, °С |
25-35 |
30-35 |
18-30 |
13-18 |
25-30 |
18-25 |
18-25 |
15-20 |
70-80 |
18-25 |
60-80 |
30-50 |
20-40 |
|
Время, с или мин. |
ДО 180 |
до 10 |
60 |
до 4 |
20-60 |
20-60 |
1-5 |
0,5-3 |
2-3 |
до 2 |
1-10 |
до 2 мин. |
до 60 с |
|
Пл. тока, А/дм2 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
15-80 |
- |
_ |
Эксплуатация и составление указанных ванн трудностей не представляет. Для приготовления состава №1 к раствору серной кислоты доливают перекись водорода, а затем стабилизирующую добавку. В качестве последней обычно используется этиловый спирт, глицерин или этилен-гликоль. Недостатком этого рецепта является его нейтральность, вызванная разложением пергидроля. Поэтому данный компонент вводить необходимо непосредственно перед работой. При травлении в составах, содержащих азотную кислоту, выделяется коричневый и очень едкий дым. Поэтому операции травления допускается проводить только при наличии хорошей принудительной вытяжной вентиляции. Снижение блеска является в основном следствием понижения концентрации азотной кислоты, чрезмерного уменьшения температуры или общего истощения рабочего раствора.
При работе с растворами полирования следует учитывать, что время обработки в активных растворах, а их рецептура приводится под нечетными номерами, указано в секундах. Эти составы наиболее пригодны для обработки довольно толстых слоев, когда исключена опасность чрезмерного съема металла. Химическое полирование тонких гальванических и химических покрытий лучше всего осуществлять в медленно работающих ваннах, Рецептура последних указана под четными номерами, а продолжительность процесса - в минутах. Протравливание ведут до появления устойчивого металлического блеска. Рецепты №1-4 предназначены для обработки меди и ее сплавов с содержанием Cu не менее 80%. В составах №5 и 6 выполняется химическое полирование латуней, а в растворах №7 и 8 - медно-оловянных сплавов. Для медно-никелевых сплавов используются рецепты №9 и 10. В этой же таблице под №11 помещен состав наиболее распространенной универсальной ванны электрохимического полирования. При обработке в ней детали завешиваются на аноде. В качестве материала для катодов применяется свинец либо коррозийностойкая сталь 12Х18Н9Т. В ходе описанных процессов на поверхности заготовок образуется слой травильного шлама. Последние удаляют в растворе №12 и после промывки поверхность металла подвергается активации в составе №13.
Последним этапом обработки деталей является придание ее поверхности декоративной окраски и, если это необходимо, пассивация поверхности. Из всей возможной цветовой гаммы выбираем: белый, темно-коричневый и черный цвета . Однако бывает и так, что оксидные и т.п. пленки не обеспечивают достаточной коррозионной стойкости заготовок, выполненных из черных металлов. В такой ситуации прибегают к защитно-декоративному никелированию поверхности изделия. Эта операция в принципе ничем не отличается от функционального никелирования, которое было описано выше, за исключением одного нюанса: при покрытии стали никелем важно снизить количество пор в осажденной пленке, В противном случае ржавчина, проникающая под слой металла, быстро разрушит его. Закрыть поры в никелевом покрытии можно с помощью двукратного осаждения металла. Для этого первый слой никеля подтравливают в течение 3...5 с в 50%-ном растворе азотной кислоты и далее, после тщательной промывки водой, заготовку покрывают металлом второй раз. Второе покрытие обязательно выполняется в истощенном растворе, т.е. в котором уже было отникелировано большое количество деталей.
При выполнении заготовки из меди или ее сплавов нужды в двухслойном никелировании нет, поскольку эти материалы и так обладают достаточной устойчивостью против коррозии. Но здесь есть другая тонкость, и если ею пренебречь, то процесс осаждения металла не пойдет. Это связано с тем, что у меди меньший электроотрицательный потенциал по отношению к никелю и только присоединение или касание с деталью более электроотрицательных металлов, например, алюминия, железа даст старт всему процессу, поэтому заготовка должна быть завешена в раствор на алюминиевой или стальной проволоке, В крайнем случае после опускания детали в рабочую ванну к ней необходимо прикоснуться алюминиевым или железным предметом. При этом в месте контакта начинает осаждаться никель. Последний, обладая высокой каталитической способностью, как бы <заражает> всю поверхность детали.
Таблица 4 химическое окрашивание
|
Вещество, г/л |
№1 |
№2 |
№3 |
№4 |
|---|---|---|---|---|
|
Основный карбонат меди |
200 |
- |
- |
- |
|
Сульфат меди |
- |
105 |
50 |
50 |
|
Сульфат никеля |
. |
20 |
- |
_ |
|
Перманганат калия |
- |
- |
- |
5 |
|
Хлорид калия |
- |
45 |
- |
- |
|
Тиосульфат натрия |
- |
- |
50 |
- |
|
Нашатырный спирт 25% |
1 Л |
- |
- |
- |
|
Температура, °С |
15-35 |
90-100 |
60-80 |
18-25 |
|
Время, мин. |
25-30 |
до 10 |
до 20 |
до 60 |
Из <медной> группы металлов латунь наиболее легко поддается процессам окрашивания. Из чисто <химических> растворов, как правило, применяется состав №1 из табл.4. Недостатком этого способа является резкий и неприятный запах аммиака. Коричневый цвет достигается при обработке латунных деталей в растворах №2-4. В зависимости от рецептуры и химического состава металла получим цвет от красно-коричневого (цвет красного дерева) до глубокого бархатного черно-коричневого.
Таблица 5 Электрохимическое окрашивание
Вещество, г/л |
№1 |
№2 |
№3 |
№4 |
№5 |
№6 |
№7 |
|---|---|---|---|---|---|---|---|
Сульфат меди |
- |
- |
- |
- |
25 |
- |
4 |
Сульфат никеля |
- |
- |
- |
- |
25 |
- |
- |
Серная печень |
- |
- |
100 |
- |
- |
10-20 |
- |
Ацетат меди |
- |
- |
- |
- |
- |
- |
30 |
Гидроксид натрия |
250 |
50-60 |
40-60 |
- |
- |
. |
|
Нитрат натрия |
- |
- |
- |
5-10 |
- |
- |
- |
Сульфид натрия |
- |
. |
. |
- |
- |
6 |
- |
Перманганат калия |
- |
- |
. |
7 |
- |
- |
|
Персульфат калия |
- |
14-16 |
- |
13-17 |
- |
- |
- |
Гипохлорид калия |
- |
- |
- |
. |
12 |
- |
- |
Аммония хлорид |
- |
- |
. |
- |
- |
20 |
0,5 |
Ацетат аммония |
- |
- |
- |
- |
- |
- |
50 |
Температура, °С |
80-90 |
60-65 |
50-80 |
95-97 |
100 |
100 |
100 |
Время, с |
20-30 |
до 5 |
до 20 |
2-3 |
до 3 |
до 10 |
до 10 |
Пл, тока, А/дм2 |
0,6-1 |
- |
- |
- |
- |
- |
Для окрашивания меди в черный цвет чаще всего прибегают к электрохимической обработке в растворе №1 табл.5. После приготовления данный электролит нуждается в проработке под током на случайных медных анодах до появления устойчивого голубоватого оттенка. В процессе окрашивания деталь завешивают на анод, катоды из коррозионно-стойкой стали. Состав №2 является стандартным раствором химического чернения меди и широко применяется в промышленности. Его характерной особенностью является внезапное выделение пузырьков кислорода на поверхности заготовки, что указывает на окончание процесса обработки. Полученная оксидная пленка имеет глубокий черный цвет и блестящую поверхность. Очень старый, но обеспечивающий получение хороших результатов рецепт №3 на основе <серной печени>. Этим же раствором можно хорошо окрасить латунь и удовлетворительно сталь. Если вы желаете получить на медной поверхности глубокий темно-коричневый цвет, то можете воспользоваться составом №2 из табл.23. Время обработки определяется визуально.
Трудно
поддаются химическому окрашиванию бронзы, что связано с присутствием в
их составе олова, причем следует помнить, что чем его больше, тем
сложнее осуществление процесса. И все же существует несколько
проверенных рецептов, показавших неплохие результаты. Они помещены в
табл.5 под номерами 4...7. Все эти составы позволяют получить цвета от
светло-коричневого до черно-шоколадного и чисто черного в зависимости
от времени. Остается добавить, что цветные пленки на меди и ее сплавах
подвергать пассивации нельзя, т.к. это может привести к их разрушению.
Покрытия на основе медно-никелевых сплавов химической обработке не
подлежат.
После полного высыхания изделия производится т.н.
заполнение покрытия. Для цветных оксидных пленок и никелевых покрытий,
нанесенных на заготовки из черных металлов, эта операция является
обязательной. Практически она осуществляется следующим образом.
Поверхность покрытия слегка смазывается вазелиновым либо иным
нейтральным минеральным маслом, после чего деталь помещают в сушильный
термошкаф, прогретый до 80-110 °С. Выдерживают изделие при такой
температуре 5...8 часов, затем медленно охлаждают. Излишки жира
тщательно удаляют каким-либо органическим растворителем, например,
бензином.